Menu principal
- Accueil
- Le chirurgien
- Consultation
- Pathologies
- Vidéos
- Album photos
- FMC
- Questions internat
- Questions Résidanat
- Quoi de neuf ?
- Livres
- -- En cours de construction --
L’hépatectomie consiste à en enlever une partie plus ou moins importante du foie. Le foie est capable de régénérer après hépatectomie et Il est possible de réséquer jusqu’à 80% du volume total du foie.

Le foie assure plusieurs fonctions métaboliques indispensables à la vie. Une ablation totale du foie est possible à condition qu’elle soit associée à une greffe hépatique.
La chirurgie hépatique est actuellement une spécialité à part entière et doit être faite par des chirurgiens spécialisés en chirurgie du foie.
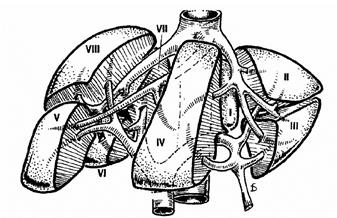
Anatomie du foie
Le foie comporte 8 segments numérotés de I à VIII.
Schématiquement le foie gauche comporte les segments I, II, III et IV et il est vascularisé par le pédicule hépatique gauche (artère et veine porte).
Le foie droit comporte les segments V, VI, VII et VIII. Il est vascularisé par le pédicule hépatique droit.



Foie éclaté ex vivo (étalé) Foie éclaté in vivo

Moule hépatique souple en silicone colorée.
Bilan avant chirurgie du foie
Avant toute chirurgie hépatique majeure un bilan biologique et morphologique doit être fait :
- Biologique :
Une numération formule sanguine, un dosage des enzymes hépatiques (Transaminases, phosphatases alcalines, γ GT), de la bilirubine, de la créatinine et un bilan de la coagulation (taux de prothrombine, temps céphaline activé et facteur V).
Le dosage des marqueurs tumoraux est fait en cas de suspicion de tumeur maligne : α-fœto protéine, ACE et CA 19-9.
- Morphologiques : Scanner thoracoabdominal et IRM abdominale.
- La consultation pré-anesthésique complète le bilan (avec un bilan d’opérabilité, ECG, radiographie pulmonaire, EFR).
Principes d’une hépatectomie
Conduite générale des hépatectomies
L’intervention est faite sous anesthésie générale.
Prise d’une voie veineuse centrale,
Une sonde urinaire est mise en place pour surveiller la diurèse,
Un scope pour le monitoring cardiaque et un oxymètre pour la surveillance de l’oxygénation tissulaire.
L’intervention peut être faite par laparotomie ou par cœlioscopie.
- Par laparotomie, l’incision est une sous costale droite élargie au besoin à gauche. Le tracé
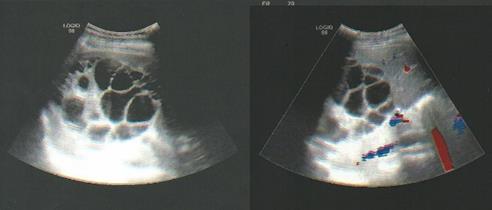
de l’incision suit le rebord des côtes. Après ouverture de la cavité abdominale et exploration soigneuse de l’abdomen, une échographie peropératoire est faite pour préciser le siège de la lésion et surtout les rapports avec les pédicules vasculaires et également pour rechercher des lésions méconnues par les examens préopératoires.
Le foie est mobilisé par section de toutes ses attaches ligamentaires.
Le pédicule hépatique est ensuite préparé pour un éventuel clampage pédiculaire,
En effet l’hémorragie reste la complication la plus fréquente et la plus grave des hépatectomies. Pour réduire le saignement il faut arrêter momentanément le flux sanguin artériel hépatique et portal en mettant un clamp sur le pédicule hépatique. Le pédicule hépatique peut être clampé pendant 45 à 60 mn sans dommage notable pour le foie.
L’intervention proprement dite commence par la section de la capsule de Glisson. Le tracé de section dépend du type de lésion :
- Le kyste hydatique compliqué du foie (Kystes hydatiques types III et IV) relève du traitement chirurgical : le tracé de section suit les limites du périkyste et l’intervention consiste en une périkystectomie à kyste ouvert ou mieux kyste fermé pour réduire au maximum le risque de dissémination parasitaire.
- Dans le cancer primitif du foie généralement un carcinome hépatocellulaire sur cirrhose, la résection doit être anatomique emportant un ou 2 segments en fonction des lésions.
- Dans les métastases hépatiques des cancers colorectaux, l’intervention est généralement une métastasectomie avec une marge de sécurité de 10 à 20 mm.
Après déclampage du pédicule hépatique un complément d’hémostase de la tranche de section est nécessaire. La biliostase doit être également contrôlée pour s’assurer de l’absence de fistule biliaire. Un drain est mis en place contre la tranche de section.
Suites opératoires
Le patient est pris en charge dans l’unité de soins intensifs pendant 24 à 48 h. Ses paramètres hémodynamiques (Tension artérielle, fréquence cardiaque, activité cardiaque, oxymétrie) sont monitorés et surveillés en permanence par des appareils électroniques qui retransmettent les résultats sur un écran.
La perfusion est maintenue pendant 3 à 4 jours, par contre la sonde vésicale et la sonde gastrique peuvent être enlevées au réveil du malade.
Les complications sont rares et surviennent généralement durant les 48 heures post-opératoires. Il s’agit essentiellement : de l’hémorragie qui peut imposer des transfusions et/ou une ré-intervention, et de l’insuffisance hépatique (foie cirrhotique) généralement transitoire.
Le patient est ensuite transféré dans le service hospitalier pour 6 à 8 jours. L’alimentera est autorisé dès le 2ème jour. Le drain abdominal est généralement retiré au 3ème jour post-opératoire.
La surveillance du patient est clinique (température, tension artérielle, examen de la plaie opératoire) et biologique (Numération et formule sanguine, transaminases et phosphatases alcalines ainsi que les facteurs de la coagulation).
2 autres complications spécifiques peuvent être observées :
-La fistule biliaire : écoulement de bile par le drain abdominal.
-la collection sous hépatique (hématome, collection de bile ou abcès). Le scanner abdominal permet de faire le diagnostic et le traitement peut être fait par voie percutanée (drainage percutanée sous anesthésie locale).
Résultats des hépatectomies:
Actuellement la mortalité postopératoire est inférieure à 2 %.
La morbidité est inférieure à 10%.
Foie : Kyste hydatique du foie
L’hydatidose ou maladie hydatique est une zoonose due au développement chez l’homme de la forme larvaire du tænia du chien, Echinococcus granulosus. C’est une parasitose qui sévit dans les pays d’élevage de moutons et peut affecter jusqu’à 5 % de la population générale et constitue de ce fait un problème majeur de santé publique.
Cette zoonose peut affecter plusieurs animaux, l’homme étant infesté accidentellement comme intermédiaire dans le cycle de l’helminthiase et constitue une impasse parasitaire.
Le traitement de l’hydatidose humaine était uniquement chirurgical, mais depuis l’introduction des médicaments benzimidozolés et l’avènement du traitement percutané écho ou scanno guidé, l’attitude thérapeutique a changé et le choix de la technique dépend de plusieurs facteurs, en particulier le stade évolutif du kyste, l’état du périkyste et la multiplicité des kystes.
Parasitologie
- Forme adulte :
Le tænia Echinococcus granulosus est un cestode de la famille des plathelminthes, qui mesure 5 à 8 mm de long, la partie céphalique ou scolex est d’aspect piriforme, pourvue de 4 ventouses arrondies et d’un rostre saillant est armé d’une double couronne de crochets. Les ventouses et les crochets assurent l’adhésion du parasite à la paroi intestinale du chien.
Le corps de tænia est formé de 3 anneaux constituant une chaîne appelée strobile. Les 2 premiers sont immatures. Le dernier anneau, proglotlide formé en 6 à 11 semaines, est un utérus gravide contenant jusqu’à 1500 œufs mûrs. A maturité, l’anneau se détache et est évacué avec les selles. Il est remplacé en 2 à 5 semaines.
-Œuf :
L’œuf est ovoïde de 35 µm entouré d’une coque épaisse striée. Il contient un embryon hexacanthe à six crochets (oncosphère).
La maturation de l’œuf a lieu dans le milieu extérieur. Sa survie dans le milieu extérieur dépend des conditions d’humidité et de température. Il résiste 1 mois à +20° C et 15 mois à 7° C, mais résiste 2 à 3 minutes à 60° C. L’œuf est détruit rapidement en quelques heures si l’hygrométrie est inférieure à 70 %.
-Forme larvaire :
C’est le métacestode d’Echinococcus granulosus du kyste hydatique. Sa vitesse de maturation est lente et dépend de l’espèce hôte et du viscère parasité.
-Cycle parasitaire :
L’Echinococcose est une cyclozoonose qui nécessite 2 hôtes.
L’hôte définitif est le chien, plus rarement le loup, le chacal ou l’hyène.
L’hôte intermédiaire est généralement le mouton. D’autres herbivores peuvent être infestés, en particulier les bovins, les caprins, les porcins, mais également le cheval et le chameau. Plus rarement, et propre à certaines régions, le renne et l’élan.
L’homme s’insère accidentellement dans le cycle évolutif du parasite et constitue une impasse épidémiologique.
Les œufs sont éliminés avec les déjections du chien dans le milieu extérieur. Les œufs souillent l’herbe, broutés par l’hôte intermédiaire herbivore. L’œuf est donc ingéré par l’herbivore, généralement le mouton et l’oncosphère dans l’estomac perd sa coque protectrice sous l’effet des sucs digestifs. L’embryon hexacanthe par ses six crochets cisaille la paroi intestinale et passe dans le système veineux porte et arrive dans le foie où il peut s’enkyster. Il peut passer le filtre hépatique et parvient au cœur droit par les veines sus hépatiques et la VCI et pénètre dans les poumons.
Plus rarement, l’embryon traverse les poumons et se retrouve dans la circulation générale et peut se fixer en n’importe quel point de l’organisme. Le passage par voie lymphatique est théoriquement possible et expliquerait les localisations inhabituelles du kyste sans atteinte hépatique.

L’embryon fixé dans un viscère peut se développer et se transformer en hydatide par phénomène de vésiculation ou être détruit par les cellules phagocytaires et la réaction inflammatoire.
Le cycle est bouclé lorsque le chien dévore les viscères infestés de l’herbivore. Les scolex ingérés par le chien se dévaginent et se transforment chacun en vers adultes dans son tube digestif.
L’homme est contaminé par le contact avec le chien porteur, atteint de téniasis à E. granolosus. L’homme contracte la maladie par ingestion des œufs selon 2 modalités :
-Par voie directe :
Le chien contamine l’homme en lui léchant le visage ou les mains ou en se faisant caresser. En effet, le chien en faisant sa toilette, se lèche l’anus et souille d’œufs sa langue et son pelage.
-Par voie indirecte :
La contamination se fait par l’eau de boisson, les légumes crus et les fruits ramassés à terre souillés par les œufs. Les œufs sont dispersés dans la nature par le vent, la pluie, les mouches coprophages, les arthropodes, mais aussi, par les chaussures de l’homme ou les pattes des animaux.
Epidémiologie
La fréquence de l’hydatidose augmente avec l’âge traduisant l’absence d’acquisition d’une immunité protectrice. L’hydatidose est une maladie de l’adulte jeune, l’âge moyen de diagnostic est de 30 ans. Il existe une prédominance féminine estimée à 70 %.
L’hydatidose est une anthropozoonose cosmopolite mais sévit surtout dans les pays d’élevage du mouton et constitue un problème majeur de santé publique dans les pays de Maghreb.
Anatomopathologie
Structure du kyste :
- Coque ou adventice
Le périkyste est constitué par du tissu de l’organe hôte écrasé par le développent de l’hydatide. En effet, le tissu entourant le kyste hydatique sous l’effet de la compression mécanique et des toxiques excrétés, se transforme en coque fibroconjonctive épaisse, dure riche en néo vaisseaux qui assurent sa vascularisation.
-Larve hydatide ou kyste hydatique comporte 2 membranes interne et externe accolées l’une à l’autre.
-Liquide hydatique : C’est un liquide limpide, eau de roche, stérile sous forte pression pouvant atteindre 100 cm d’eau plaquant les membranes hydatiques contre l’adventice.
Dans les kystes jeunes, le liquide hydatique est constitué en majorité (99%) d’eau et moins de 1% d’ions, lipides, glucides et d’acides aminés provenant à la fois du parasite et du plasma de l’hôte.
-Fertilité du kyste et vésiculations secondaires.
La membrane proligère émet des prolongements à l’intérieur du kyste, qui bourgeonnent sous formes de petits sacs à paroi translucides remplis de liquide mesurant 250 à 500 m et appendus par un pédicule fin et fragile à la membrane proligère. Ces vésicules proligères sont visibles à l’œil nu et contiennent 10 à 20 protoscolex, analogues aux scolex des vers adultes mais invaginés et globuleux.
Un kyste est d’autant plus fertile qu’il possède de protoscolex.
Les vésicules se détachant pour sédimenter au fond de l’hydatide formant le sable hydatique, culot de décantation granuleux et blanchâtre. 1ml de sable hydatique contient jusqu’à 400 000 scolex. Il n’existe pas de relation entre la fertilité et la taille du kyste.
Au cours de l’évolution des vésicules filles endogènes et exogènes peuvent se former.
En effet, après 10 à 12 mois d’évolution, les protoscolex peuvent se vésiculiser et former des vésicules filles. Les vésicules filles exogènes pénètrent dans la cuticule et sont progressivement refoulées vers l’extérieur et pénètrent plus ou moins profondément dans le perikyste.
Le protoscolex a donc un double potentiel, celui de se transformer en strobile adulte et celui de produire d’autres kystes chez l’hôte.
-Evolution du kyste
Les hydatides filles exogènes peuvent être expulsées à l’extérieur du kyste et métastaser dans l’organisme, c’est l’échinococcose secondaire. Cette diffusion peut être provoquée par la manipulation opératoire du kyste. La vitesse de croissance du kyste a pu être évaluée par échographie dans une étude menée au Kenya : 30% des kystes ont une croissance lente de 1 à 5mm/an, 45% ont une croissance modérée (6 à 15mm/an) et 11% ont une croissance rapide 30 mm/an).
La dégénérescence du kyste survient dans 16% des cas.
2 formes anatomiques :
-Kyste hydatique univésiculaire, eau de roche à périkyste fin et souple ;
-Kyste multivésiculaire, à contenu plus ou moins épais à périkyste épais et rigide et comportant une ou plusieurs fistules kysto-biliaires.
Tableaux cliniques
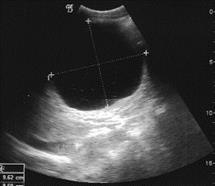
-forme asymptomatique de découverte fortuite. L’hydatidose est de plus en plus de découverte fortuite, à l’occasion d’une échographie ou d’une radiographie de l’abdomen sans préparation (ASP) faite dans le cadre d’un bilan pour une autre pathologie.
-Formes symptomatiques constituent cependant la majorité des cas. Une symptomatologie banale à type de pesanteurs de l’HD ou de dyspepsie.
-Tableau clinique aigu traduisant une ouverture du kyste dans les voies biliaires.
Ictère
Angiocholite
-Choc anaphylactique par libération d’antigènes parasitaires au cours d’une fissuration ou d’une rupture du kyste.
-Tableau de clinique de compression des organes de voisinage : En particulier compression de l’estomac (tableau gastritique), de la voie biliaire principale (ictère) de la veine porte (Hypertension portale, HTP) , des veines sus-hépatiques (Syndrome de Budd-Chiari) de la veine cave inférieure (Syndrome cave)
-Rupture du kyste dans le péritoine. 2 formes, tableau aigu et tableau chronique cholépéritoine.
-Forme tumorale : Lapalpation abdominale peut découvrir une hépatomégalie ou une tumeur indolore lisse et rénitente déformant la paroi.
-Formes compliquées. Les complications sont fréquentes. Plusieurs paramètres anatomiques ont un intérêt pronostique : siège du kyste, nombre de kystes, contenu kystique, état du périkyste et existence d’une fistule biliaire.
La rupture est asymptomatique dans 5% des cas.
La compression, dépend du siège et du volume du kyste :
Complications infectieuses :
Complications toxiques :
Les manifestations peuvent être graves mortels en quelques heures par choc anaphylactique.
Diagnostic
L’imagerie permet de visualiser le KH et les éléments constitutifs
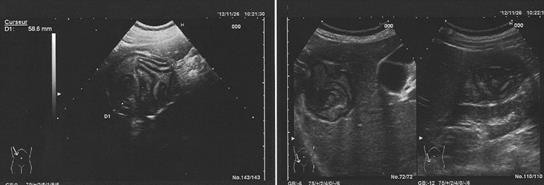
-Formes non compliquées : l’aspect varie en fonction du stade évolutif du kyste.
2 Classifications :
Classification de GHARBI
5 types de lésions :
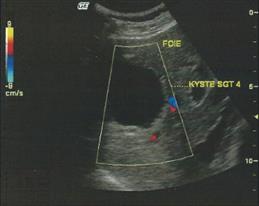
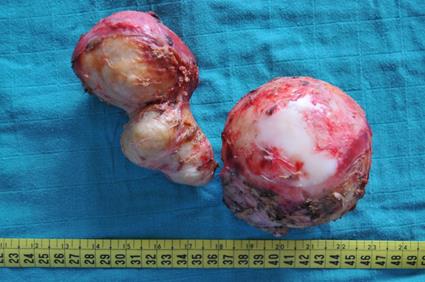
Périkystectomie totale de 3 kyste des segments I et VII.
Classification de l’OMS.
CL : Lésion kystique monovésiculaire avec un contenu anéchogène uniforme, non délimité clairement par un bord hyperéchogène (paroi du kyste non visible)
Forme : normalement ronde mais peut être ovale
Taille variable : mais généralement petite.
CE1
Kyste simple univésiculaire, avec un contenu anéchogène uniforme. La paroi du kyste est visible. De forme arrondie ou ovalaire, de taille variable.
CE2
kystes multivésiculaires, les vésicules filles réalisent l’aspect en nid d’abeilles. Les vésicules filles peuvent occuper partiellement ou complètement le kyste.
La paroi du kyste est épaisse et visible. De forme arrondie ou ovalaire
CE3
Kyste univésiculaire qui peut contenir des vésicules filles.
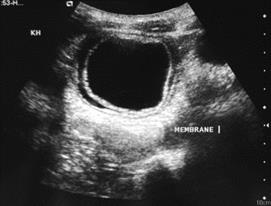
De contenu anéchogène avec détachement d’une membrane laminée de la paroi du kyste visible comme membrane flottante. La forme du kyste est moins ronde à cause de la réduction de la pression intra kystique
CE4
Contenu dégénératif, hétérogène, hypoéchogène ou hyperéchogène, sans vésicules filles. De taille variable.
CE5
Kystes caractérisés par une paroi épaisse calcifiée qui est en forme d’arc, produisant un cône d’ombre. Le degré de calcification varie de partielle à complète
Technique d’imagerie
-ASP
-Echographie abdominale, examen de 1ère intention.
Les images typiques sont à type de renforcement postérieur d’une image liquidienne,
Décollement partiel de la membrane,
Vésicules filles intra ou extrakystiques,
le sable hydatique est parfois visible au niveau du kyste sous forme de fins échos, déclives et mobiles.
Les lésions calcifiées nécessitent le recours à d’autres techniques d’imagerie.
L’échographie, et plus particulièrement l’écho-doppler, permet d’étudier les rapports du kyste avec les pédicules glissoniens et sus-hépatiques et avec la VCI rétro-hépatique.
-TDM abdominale
La TDM abdominale est essentielle avant tout acte opératoire. Elle permet de confirmer le diagnostic dans un grand nombre de cas. L’apport de la TDM peut se résumer comme suit :
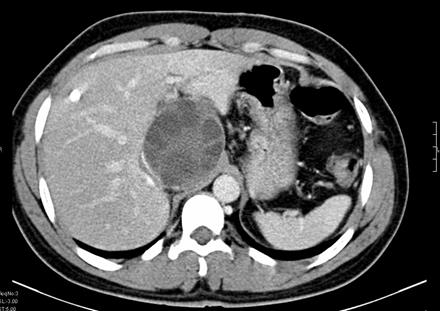
Kyste hydatique du lobe dorsal
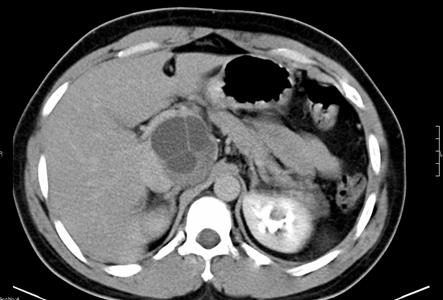
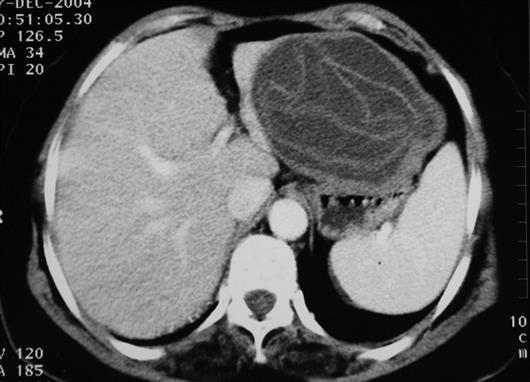
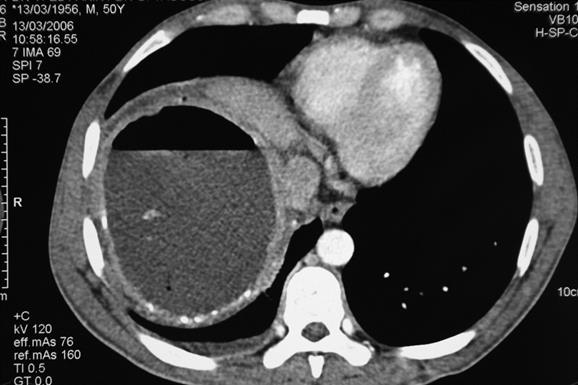
Kyste hydatique avec niveau hydroaerique
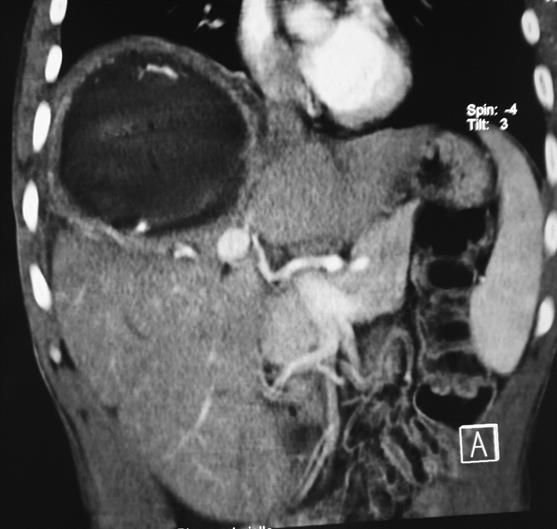
Kyste hydatique des segments IVa et VIII
-L’IRM abdominale
Ses indications sont relativement limitées lorsque l’échographie et la TDM sont en défaut
Les différents types d’images sont retrouvés par l’IRM.
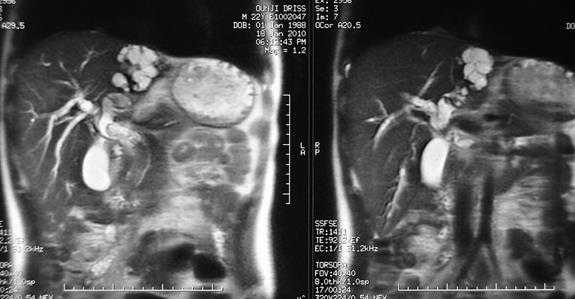
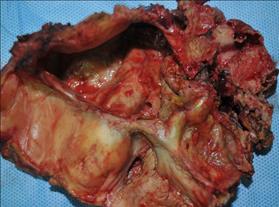
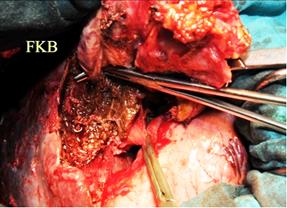
Fistule kystobiliaire du canal hépatique gauche
Diagnostic biologique
-Eosinophilie inconstante
-Les examens sérologiques : mettent en évidence les anticorps spécifiques antihydatiques.
2 techniques complémentaires :
-méthodes qualitatives
-Méthodes quantitatives
La surveillance sérologique des patients permet de contrôler l’efficacité du traitement.
Traitement
1 – Traitement médical : Les dérivés du benzimidazole ont une efficacité dans l’hydatidose.
Le 1er utilisé a été le mébendazole (MBZ) d’efficacité médiocre in vivo,
L’albendazole a une efficacité bien supérieure.
L’albendazole permet une guérison du kyste dans 30% des cas, une amélioration dans 40 à 50% des cas après 12 mois de traitement. Une absence de réponse au traitement est observée dans 20 à 30% des cas.
Le taux de réponse est de 75% avec L’albendazole et moins de 50% pour le MBZ.
L’efficacité du traitement ne peut être estimée qu’après 9 à 12 mois. Une surveillance échographique est nécessaire pour dépister les récidives.
Traitement percutané
La ponction du kyste est resté un tabou jusqu’à la fin des années 80, en raison du risque de choc anaphylactique et de dissémination du scolex.
A partir du années 90, la méthode de ponction, aspiration, injection, réaspiration s’est imposée comme une alternative thérapeutique à la chirurgie avec des indications très précises.
La ponction est faite sous contrôle échographique.
La technique de la PAIR est actuellement standardisée et comporte plusieurs étapes :
La couleur claire eau de roche du liquide hydatique et l’hyperpression du liquide sont en faveur d’un kyste frais, non compliqué.
Par contre, un liquide hydatique de couleur jaunâtre et une pression faible font suspecter l’existence d’une fistule kysto-biliaire. Une kystographie au Lipiodol fluide permet de confirmer l’existence de la fistule kysto-biliaire et contre indique la poursuite de cette méthode.
Lorsque le kyste est volumineux, un drain est laissé dans la cavité jusqu’au tarissement de l’écoulement. Le patient est gardé en observation pendant 24 h.
L’efficacité de la méthode est jugée sur la réduction immédiate de la taille du kyste. Le contenu kystique se modifie par la suite et devient solide.
Les incidents et les accidents de la technique sont relativement rares : hémorragie, infection du kyste, fistule biliaire. Le choc anaphylactique est exceptionnel.
Chirurgie
3 Objectifs :
- Voies d’abord : Médiane xypho-ombilicale et surtout sous costale droite, voie d’abord de choix en chirurgie hépatique. Voie cœlioscopique, encore discuté en raison du risque de dissémination du scolex.
- Exploration peropératoire du foie (Echographie peropératoire et cholangiographie)
- Protection de la cavité abdominale, vidange et stérilisation du contenu kystique.
Méthodes conservatrices :
Marsupialisation, abandonnée
Résection du dôme saillant
Traitement de la fistule kysto-biliaire : Confirmation de la fistule

Ponction du kyste au trocart de Devé après protection du dôme saillant par des champs secs.

Aspiration et vidange du kyste hydatique
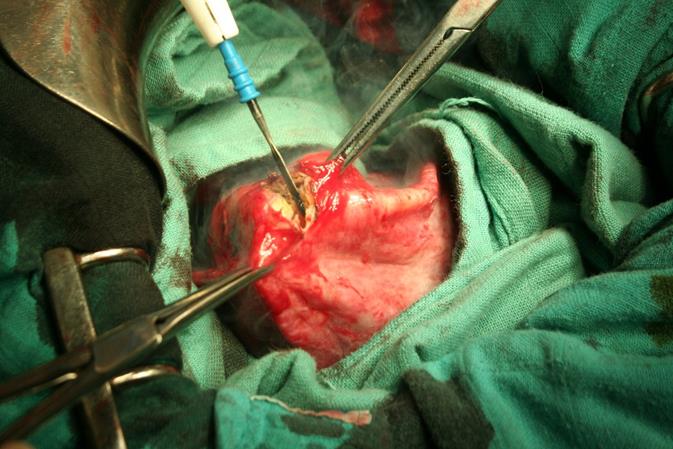
Ouverture du périkyste au bistouri monopolaire
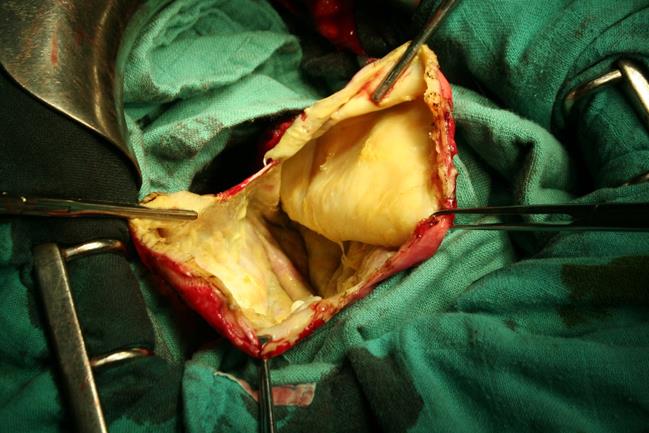
Nettoyage de l’endokyste et recherche des fistules kystobiliaires.
- Le traitement de la cavité résiduelle : Drainage externe, comblement par le grand épiploon.
Traitement des fistules biliokystiques larges.
Méthodes radicales :
Avantages
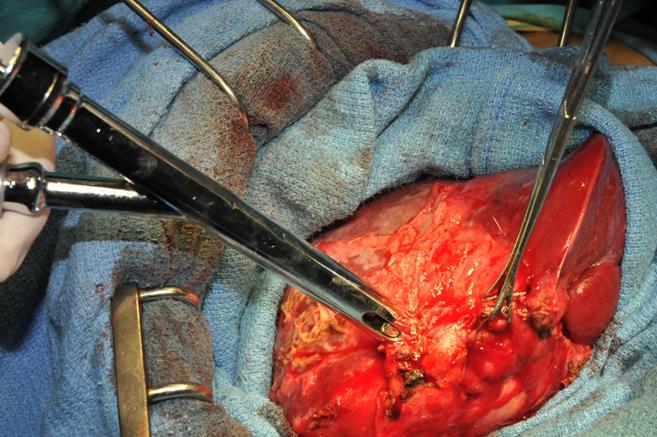
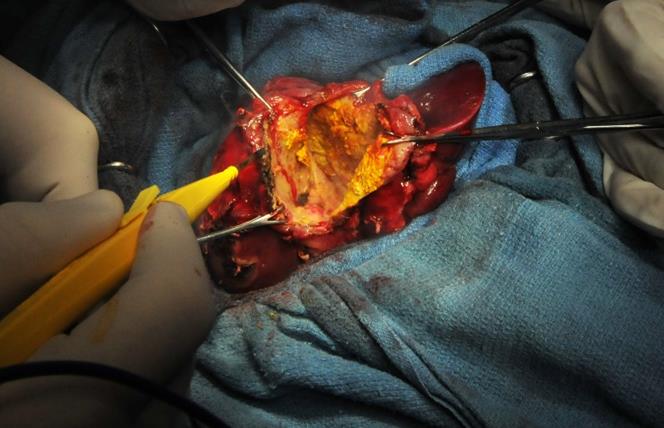
Périkystectomie à kyste ouvert : Ponction du kyste
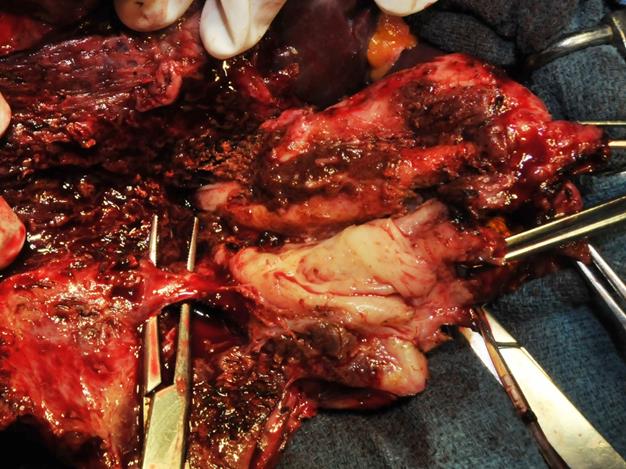
Fistule kystobiliaire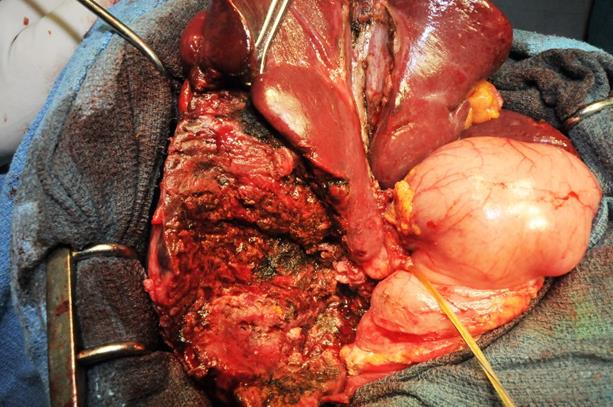
Périkystectomie totale : Ligature de la fistule kysto-biliaire
Epreuve au bleu de méthylène par le drain trans-cystique après
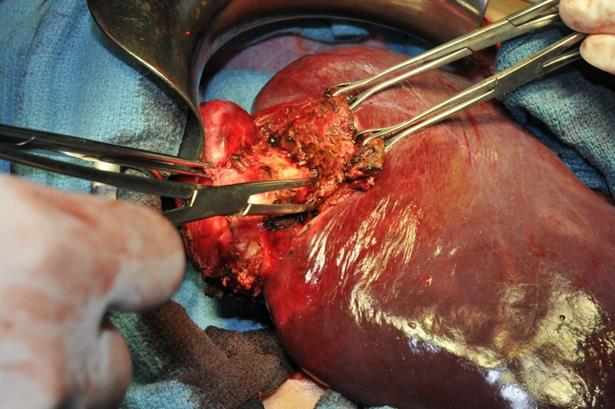
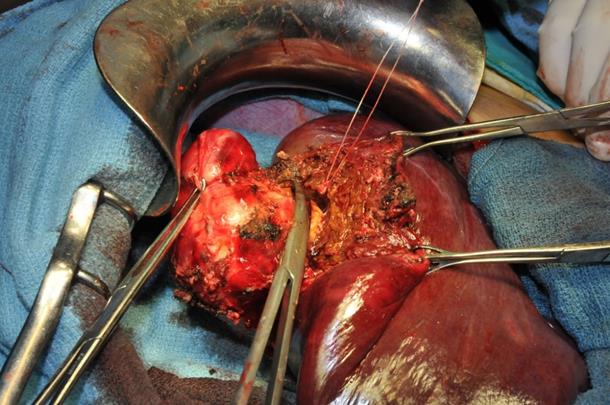

périkystectomie totale.
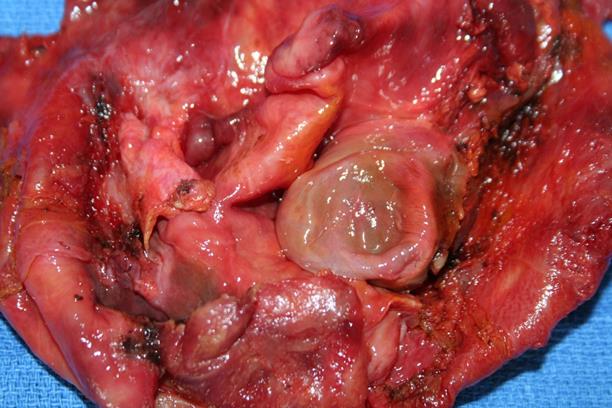
Vésicules exogènes (Pièce de périkystectomie totale)